1.前言
在之前的文章中(超高通量悬浮芯片新策略)我们介绍了一种编码微球悬浮芯片技术的编码策略,该策略制备了 300 种不同编码元素组合的编码微球,配合流式细胞仪解码可以实现这 300 重编码微球的准确解码 [1]。本期我们从解码的角度来聊一聊悬浮芯片的新型解码策略——成像解码。
悬浮芯片编码微球的准确解码是其实现多重定量检测的关键。解码过程一方面涉及微球本身编码信号的读取,另一方面涉及编码微球表面报告分子的信号读取,并经过数据处理和分析得到待测样本中多种组分的浓度(含量)信息。悬浮芯片的解码方式分为流式解码和成像解码。
2.流式 vs 成像
流式解码是目前最广泛使用的解码方式。该方式以流式细胞术为基础,利用鞘流将编码微球在毛细管道中进行排列,通过逐个激发并采集高速流过的编码微球荧光信号实现解码。虽然流式解码具有高准确度、高通量的优点,但是也存在以下不足:①仪器成本高、维护难度大、运输要求高。流式细胞仪的仪器结构较为复杂,涉及激光器、精密注射泵、光电倍增管(PMT)/雪崩二极管(APD)、复杂流体系统等较为精密的组件。②应用方式不够灵活。虽然流式解码使用较为方便,实验人员只需要将编码微球悬液置于吸样针下方即可将样本送入仪器自行检测。但是流式细胞仪系统较为封闭,且自行定制化开发难度较大。因此无法在其他反应平台(如孔板、固相载体、微流控腔室等)上直接进行解码,限制了其应用。
成像解码以荧光显微成像技术为基础,通过相机采集编码微球的荧光信号并结合图像分析进行解码。由于光学模块简单,且不需要对编码微球进行依次排列和高速信号采集,因此仪器相对结构简单。使得成本较低、可自行维护、且易于实现便携式。另外应用场景也较为灵活,可以很方便地与孔板、固相载体、微流控芯片等多种平台嫁接,拓展了悬浮芯片的应用场景。以 Quanterix 公司的单分子检测平台 SimoaTM 为例,编码微球被逐个装载至微流控盘片中的微孔阵列中,而后通过荧光显微成像系统进行拍照并结合图像分析完成解码[2]。在这种情况下,必须借助成像才能完成编码微球的解码。
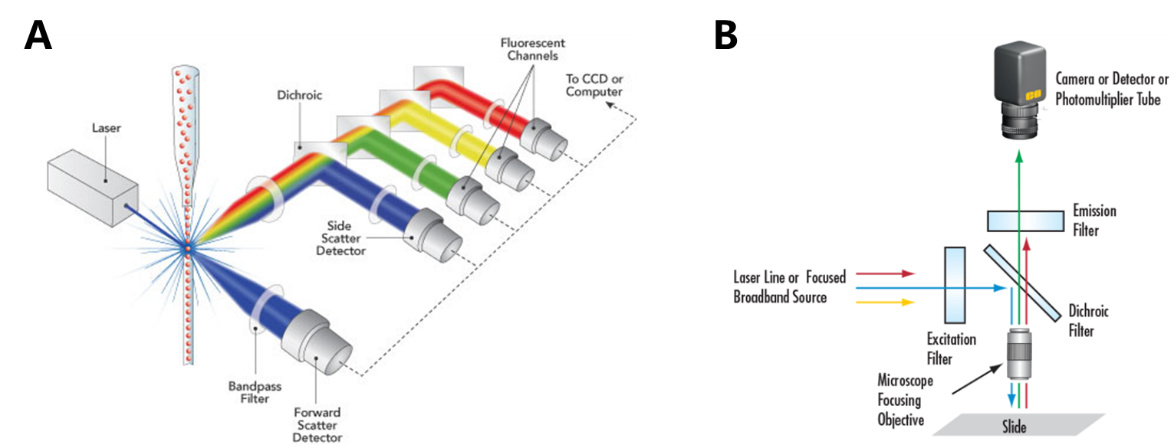
图 1 用于悬浮芯片解码的(A)流式系统和(B)荧光显微成像系统示意图[3]
3.Luminex MAGPIX®成像解码平台
Luminex 公司在基于流式的 Luminex 100/200TM 平台取得成功后,于 2010 年又推出了价格更低、体积更紧凑的 MAGPIX® 平台。同时具备了流式和成像双重解码平台。成像解码的基本要素主要包含流体模块、光学模块、图像分析和数据处理软件三个部分。下面以 MAGPIX® 平台为例分别进行介绍:
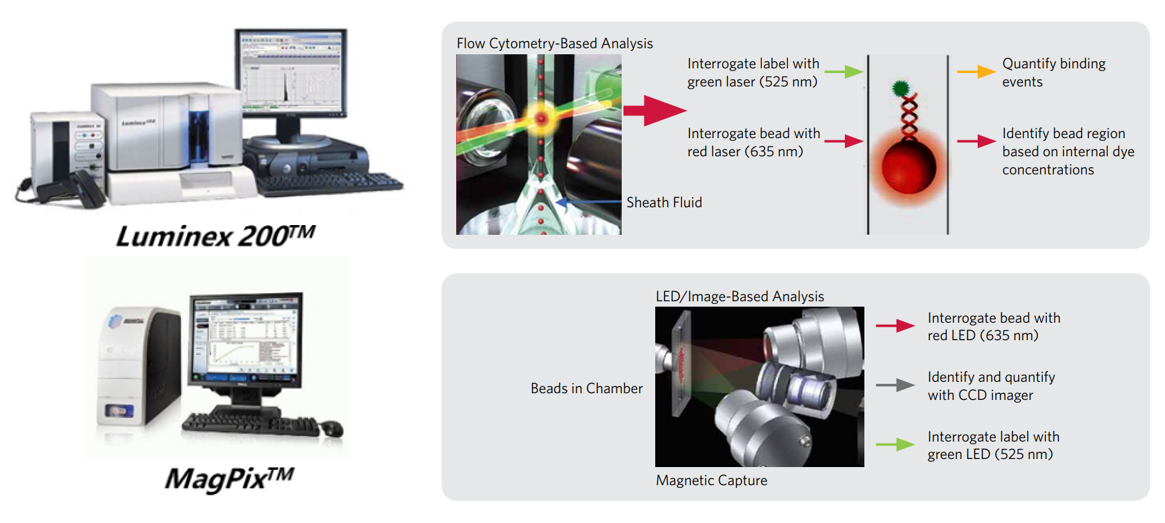
图 2 Luminex 分别基于流式和成像的解码平台示意图[4]
3.1 流体模块
流体模块主要功能是将编码微球悬液传送至成像区域,并完成一些清洗步骤。如图 3A 所示,MAGPIX® 平台的流体模块包含进样针、样本阀、样本回路、双向泵、微流控腔室、清洗液储存容器和废液储存容器[5]。双向泵驱动样本针从 96 孔板中吸取反应完成的编码微球悬液后通过样本阀进入样本回路。而后双向泵反向将清洗液储存容器中的溶液吸出,推动样本回路中的编码微球悬液进入垂直放置的微流控腔室进行成像。最后编码微球悬液被清洗液推送进入废液储存容器,完成一个样本的信号采集。
图 3B 所示的微流控腔室是流体模块的核心,用于编码微球的成像,因此是由石英等高透射反射比的材料制成。编码微球悬液在进入腔室后,会被位于腔室侧壁外的磁铁吸引,并固定在腔室内壁。该步骤一方面保证编码微球在成像时的静止状态,另一方面保证了所有编码微球处于同一成像焦平面。此外,流体的流速、磁铁的磁力和位置对编码微球的均匀分散程度也有影响。
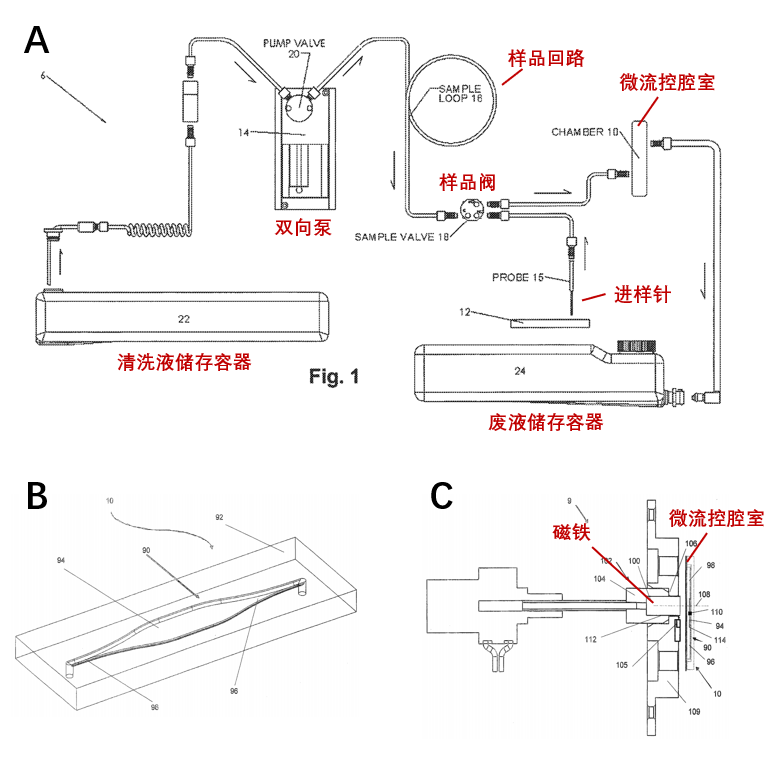
图 3 MAGPIX® 的(A)流体模块、(B)微流控腔室和(C)磁场控制模块示意图[5]
3.2 光学模块
用于成像解码的光学模块类似于一个荧光显微成像系统。包含照明光源、物镜、滤光片、相机。MAGPIX® 分别采用 525 nm 和 635 nm 两束 LED 作为微球的编码通道和报告通道的激发光源,采用 CCD 相机进行编码微球的成像。如图所示,MAGPIX® 将这两种 LED(共 6 颗,且每颗 LED 前方装有相应波长的带通滤光片)配置成「环」形照明空间,在微流控腔室内形成均匀的照明场,对编码微球进行激发。微球被激发出的荧光通过一个 4 倍放大的物镜后再经过一个滤光片转盘,最终被 CCD 相机采集。通过 LED 的开关以及滤光片转盘的转动切换,实现对编码信号和报告分子信号的分别激发和采集[5]。
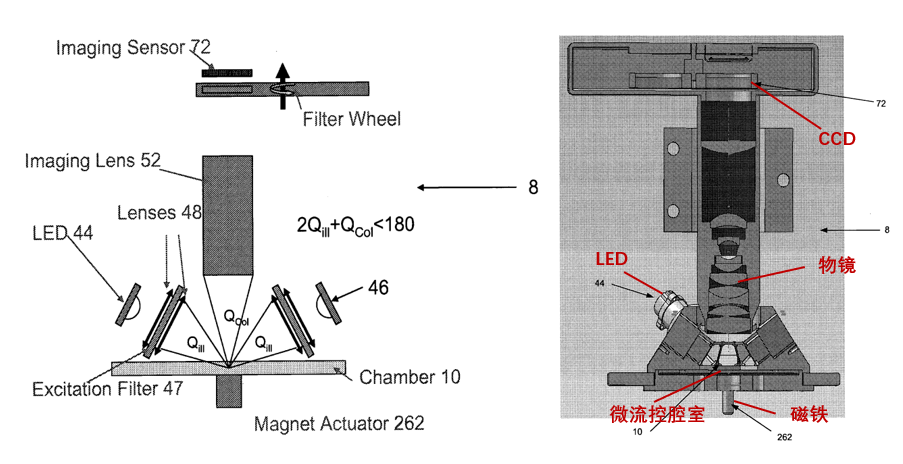
图 4 MAGPIX® 光学模块示意图[5]
3.3 图像分析和数据处理软件
通过光学模块采集到的图像经由图像分析软件进行分析和数据处理。主要包含以下三个步骤:①图像前处理。主要目的是为了让图像从整体水平上更有利于进一步识别和提取微球信息。采用的方法包括图像背景扣除、滤波降噪、提高对比度、插值运算提高分辨率等。 ②微球识别和灰度提取。主要目的是为了对图像中的编码微球进行准确的识别和灰度信息提取。采用的方法包括图像偏移矫正、阈值分割、边缘检测、形态学处理和筛选、卷积神经网络等。③聚类分析。主要目的是将提取到的编码微球按照编码通道(635 nm通道)下提取的灰度进行分类,形成相应的编码微球团簇。然后再将各团簇微球在报告通道(525 nm通道)下提取的灰度分别输出。最后进行统计学计算,包括均值/中值、标准差、变异系数等。图6显示了一部分的编码微球聚类分析流程[6]。
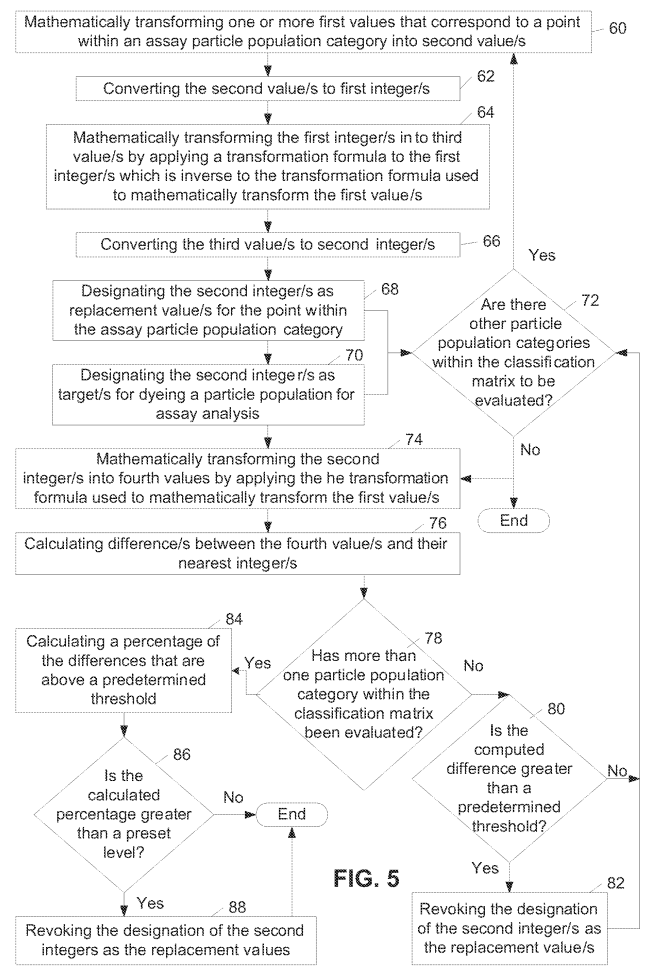
图 5 编码微球聚类分析的部分流程示意图[6]
4.成像解码平台的性能分析
前面讲到,成像平台具有性价比高、小型化、应用更灵活等优点,但是也存在一些不足,主要体现在解码容量和流式平台还略有差距。主要原因有以下三点:①荧光显微成像的信号采集效率相对于流式较低。流式细胞仪通过激光器的高能光束依次激发排列通过的单个编码微球,产生的荧光信号被高灵敏的 PMT 或 APD 接收并直接转换为数字信号,因此激发和采集效率都很高。相比之下成像解码采用宽场照明方式激发视场面积下的多个编码微球,荧光信号经由物镜和成像光路后被面阵 CMOS 或 CCD 相机采集,因此激发和采集效率相对较低。②用于成像的 CMOS 或 CCD 的动态范围相对较低。和流式细胞仪采用的光电探测器 PMT 的动态范围(最高能达到 1013:1 量级)相比,CMOS 或 CCD 的动态范围一般较窄(最高 105:1 量级)[7],限制了编码信号采集的范围,因此解码容量也相对较低。③成像解码依赖于较为复杂的图像分析算法,算法的鲁棒性和稳定性直接影响解码的准确度和灵敏度,从而影响解码容量。还是以 MAGPIX® 为例,和基于流式解码的平台 Luminex 200TM 相比,解码容量从 100 重降到了 50 重。从解码散点图中可以看出,成像解码的阵列相比流式解码阵列去除了较低以及较高荧光的团簇,只保留了中间的那部分团簇,说明成像解码容量降低可能主要由于成像系统激发和信号采集效率不高、相机动态范围相对较窄导致[8]。

图 6 Luminex 200TM 和 MAGPIX® 解码阵列对比[8]
尽管解码容量有所下降,但是成像平台在实际检测中的性能与流式平台相当。文献报道 MAGPIX® 对 oligo DNA、细胞因子、新冠中和抗体 IgG 的检测性能均与流式平台 Luminex 100/200TM 相当(图7)[9,10]。此外,实际真正需要 50-plex 以上的应用场景非常少。因此在绝大多数情况下,成像平台可以替代现有的流式平台。从而节约成本和实验室空间。更重要的是,成像平台可以提供更多的应用可能。除了前面提到的 Simoa 单分子检测平台,成像平台可以使得悬浮芯片在更加多样化的微流控芯片内的应用成为可能,包括单细胞分析[11]、多重 POCT 检测[12]等,大幅拓宽了悬浮芯片在生物医学领域的应用范围。
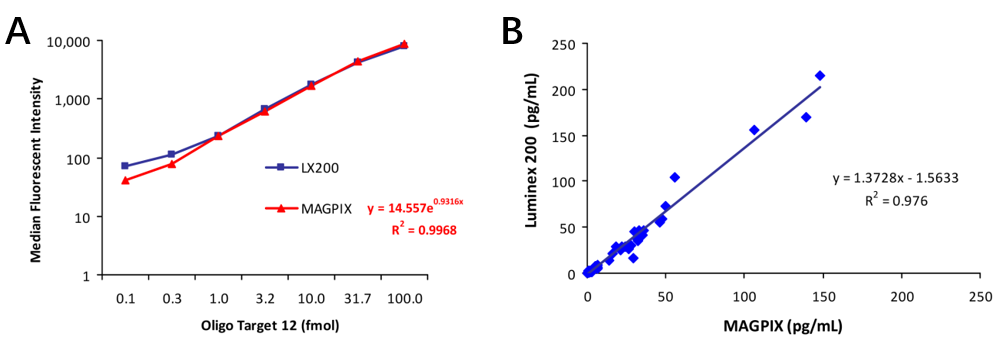
图 7 流式平台和成像平台用于(A)oligo DNA 和(B)细胞因子检测的性能对比
5.总结和展望
尽管目前流式平台在悬浮芯片市场占据绝对优势,且很多医院、检验所都已作为常规检验设备进行配备,替换难度较大。但是平台本身的特点使得其应用范围和应用场景受到限制,影响了悬浮芯片进一步发展和前进的脚步。相比之下,成像平台在性价比、仪器占用空间等方面具有绝对的优势,且保留了悬浮芯片的强大多重检测能力和检测性能。此外,成像平台可以大幅拓展悬浮芯片的应用范围。我们推测,未来成像平台将成为悬浮芯片的主流平台,并基于此能够更加充分地发挥悬浮芯片的优势,诞生出更多的新技术和新平台。
参考文献和资料
[1] Y. Wang, C. Chen, J. He, Y. Cao, X. Fang, X. Chi, J. Yi, J. Wu, Q. Guo, H. Masoomi, C. Wu, J. Ye, H. Gu, H. Xu*. Small, 2021, 17, 2100315.
[2] Rissin D M, Kan C W, Song L, et al. Multiplexed single molecule immunoassays[J]. Lab on a Chip, 2013, 13(15): 2902-2911.
[3] Optical Microscopy Application: Fluorescence. https://www.edmundoptics.com/knowledge-center/application-notes/microscopy/optical-microscopy-application-fluorescence/.
[4] Optimization of Bead Loading for MAGPIX. Luminex.
[5] Systems and Methods for Performing Measurements of One or More Materials. U.S. Patent 8296088. 2012-10-23.
[6] Methods, Storage Mediums, and Systems for Configuring Classification Regions with in a Classification Matrix of an Analysis System and for Classifying Particles of an Assay. U.S. Patent 8250021. 2012-8-21.
[7] Broadwater R. J., A Comparative Study of Photomultiplier Tubes and Charge Coupled Devices in Glow Discharge-Optical Emission Spectrometry. Master's Theses. 2003, 1422.
[8] Dunbar S. A., Li D., Introduction to Luminex xMAP Technology and Applications for Biological Analysis in China. Asia-Pacific Biotech News, 2010, 14, 10, 15-33.
[9] Equivalent Analytical Performance Between the New MAGPIX® System and the Luminex® 100/200™ System. Luminex.
[10] Du J, Chu E, Zhang D, et al. A high-throughput Anti-SARS-CoV-2 IgG testing platform for COVID-19. Journal of virological methods, 2021, 287: 114009.
[11] Zhao P, Bhowmick S, Yu J, et al. Highly multiplexed single‐cell protein profiling with large‐scale convertible DNA‐antibody barcoded arrays[J]. Advanced Science, 2018, 5(9): 1800672.
[12] Chen H, Chen C, Bai S, et al. Multiplexed detection of cancer biomarkers using a microfluidic platform integrating single bead trapping and acoustic mixing techniques. Nanoscale, 2018, 10(43): 20196-20206.
本文作者
郭庆生 博士
上海交通大学生物医学工程学院
上海羧菲生物医药有限公司
研究方向:新型微纳材料在体外诊断中的应用;基于微流控芯片平台的集成式免疫分析系统
在微纳材料合成和表面修饰、微流控芯片的开发和应用、光学成像系统和图像分析软件领域具有多年研究经验。相关成果发表在Small,Biosens. Bioelectron.,Chem. Commun.,ACS Appl. Mater. Interfaces等期刊,并授权多项专利。目前正在将快速、免洗悬浮芯片多重检测系统进行成果转化和产品化。
上海羧菲生物医药科技有限公司拥有多年 IVD 微球制备及修饰工艺经验,以及多项自主开发的核心技术。公司秉承着以纳米精度支撑生命健康的使命,着眼于技术发展趋势及行业需求,为 IVD、生物医药产业发展和改善人类健康服务。
更多相关知识与合作,欢迎关注羧菲生物公众号