发光氧通道免疫分析(Luminescent Oxygen Channeling Immunoassay, 以下简称「LOCI 分析技术」)是一种均相免疫分析技术。LOCI 技术最早由德灵诊断(Behring Diagnosis Inc.)的 Edwin F. Ullman 等学者提出并开发,相关研究成果发表在 PNAS1 及 Clinical Chemistry2 等期刊上。
LOCI 分析技术的工作原理
LOCI 分析技术主要依托「受体微球」与「供体微球」两种聚合物纳米微球实现检测。如图 1 所示,检测体系中存在待测物时,两种微球表面修饰的抗体与待测物发生免疫反应,形成免疫复合物。经激发光照射检测体系,复合物中的供体微球产生的单线态氧扩散至受体微球,受体微球中的化学发光试剂捕获单线态氧后产生光信号。由于单线态氧活性高、半衰期短,只有当供体微球和受体微球距离足够接近(形成免疫复合物)的情况下,供体微球释放的单线态氧才能有效地到达受体微球,从而产生一系列化学反应,发射出反斯托克斯光信号。当体系中不存在待测物时,即不形成免疫复合物,游离供体微球产生的单线态氧快速在体系中耗散,几乎不产生 LOCI 信号。以上就是 LOCI 分析技术的简要工作原理。
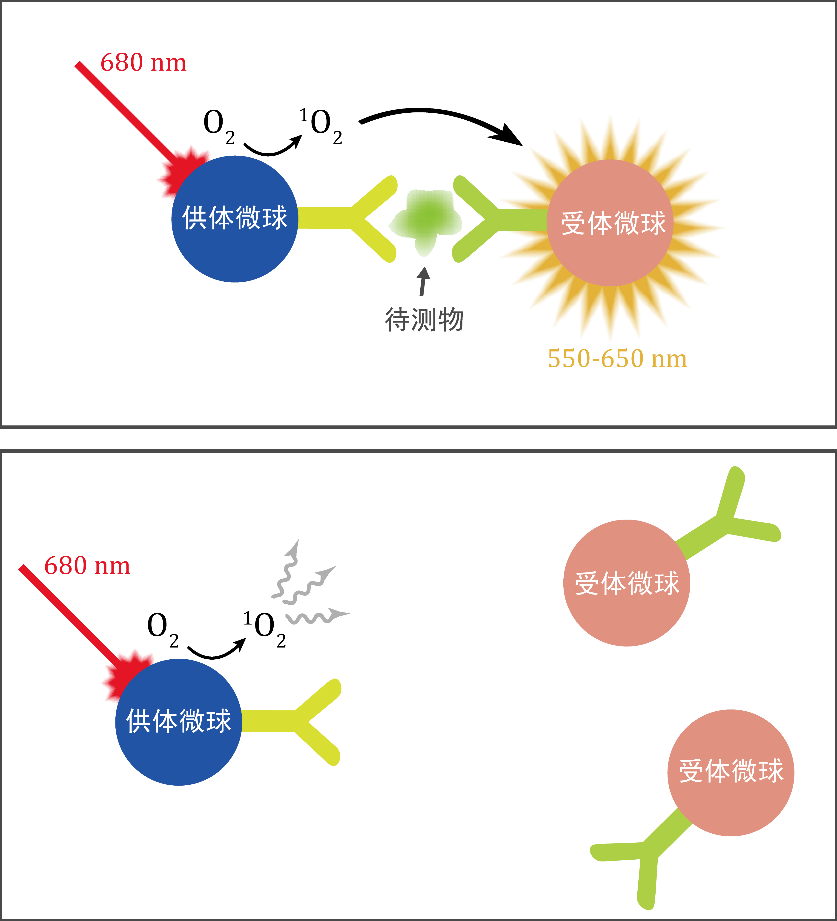
图 1 LOCI 检测示意图
LOCI 分析技术的优势
1.均相免洗
不同于目前市场上主流的非均相免疫分析技术,LOCI 检测反应为均相反应模式且游离的标记物不产生检测信号。因此,不需要多次洗涤去除游离的标记物,反应过程无需清洗和分离,只需检测试剂与待检测样本充分反应后,使用光激发,测定光信号的强度即可完成检测。因此,LOCI 分析技术大大缩短了检测流程及检测时间。
2.抗干扰
发光检测技术中,消除背景荧光的干扰对于提高检测灵敏度、重现性等具有重要意义。LOCI 分析技术利用单线态氧介导的能量传递过程,实现了「长波激发-短波发射」的反斯托克斯发光,几乎完全消除了基质中背景荧光物质对检测分析的干扰,从而大大提高了 LOCI 分析技术的检测性能。同时,LOCI 分析中的光信号还具有长寿命发光的特点,可以利用时间分辨或时间门技术进一步消除背景信号的干扰。
LOCI 技术的前沿应用
1.细胞外囊泡分析
自 2013 年诺贝尔生理学或医学奖授予美国科学家詹姆斯·罗思曼、兰迪·谢克曼以及德国科学家托马斯·祖德霍夫以来,细胞外囊泡作为一类重要的疾病标志物,持续受到关注。而细胞外囊泡的分离纯化一直是分析过程中的重大挑战,为了克服这一挑战,Takahiro Ochiya 等学者利用 LOCI 技术构建了一种免纯化的细胞外囊泡分析方法(图 2)。3 通过在供体微球和受体微球表面修饰特定抗体,当目标细胞外囊泡存在时即会形成可有效进行单线态氧传输的免疫复合物,不需要复杂而冗长的纯化过程,即能产生 LOCI 信号实现检测目标。
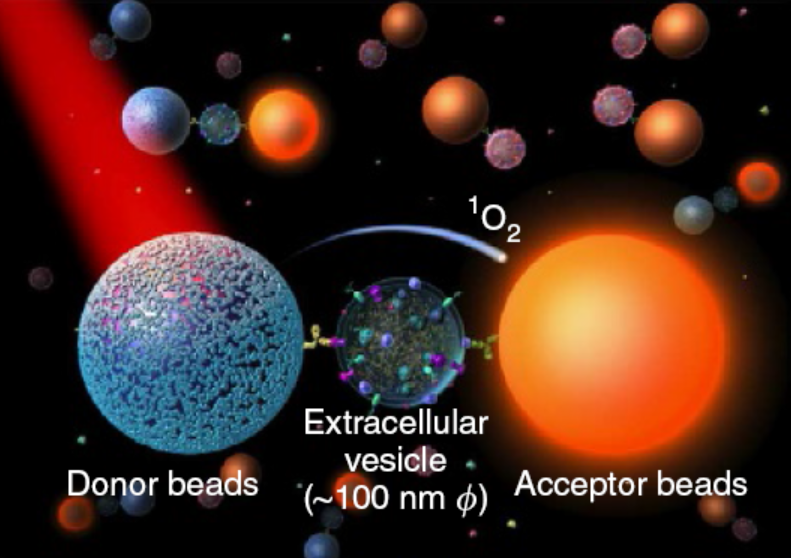
图 2 LOCI 技术用于细胞外囊泡分析3
2.微流控芯片
均相免洗是 LOCI 技术的一大特色,应用 LOCI 技术可以极大地简化微流控芯片的设计,降低其制备成本。在 Katsuo Kurabayashi 等学者发表的研究中,通过将 LOCI 技术与微流控芯片技术相结合,简化了微流控芯片的结构和检测流程,实现了一种可批量制造、可大规模生产且坚固耐用的免疫分析微流控装置。4 Jianping Fu 等学者则是在微流控芯片上构筑了用于高通量 LOCI 检测的装置,实现了 45 分钟内在单个芯片上同时完成 8 个样本的检测需求,检测限低至 10pg mL-1。5
综上所述,作为一种新型的化学发光免疫分析方法,LOCI 分析技术相对传统免疫分析技术(如 ELISA、流式分析等)具有均相免洗、高灵敏、操作简便、易于自动化等诸多优势。其在国内的受关注度也持续提高,国内已有多家知名厂商在积极布局 LOCI 相关原材料、仪器的研发,相信这会是一项改变未来免疫检测市场格局的革命性技术。
1. Ullman, E. F.; Kirakossian, H.; Singh, S.; Wu, Z. P.; Irvin, B. R.; Pease, J. S.; Switchenko, A. C.; Irvine, J. D.; Dafforn, A.; Skold, C. N.; et al., Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proc. Natl. Acad. Sci. U. S. A. 1994, 91 (12), 5426-5430.
2. Ullman, E. F.; Kirakossian, H.; Switchenko, A. C.; Ishkanian, J.; Ericson, M.; Wartchow, C. A.; Pirio, M.; Pease, J.; Irvin, B. R.; Singh, S.; Singh, R.; Patel, R.; Dafforn, A.; Davalian, D.; Skold, C.; Kurn, N.; Wagner, D. B., Luminescent oxygen channeling assay (LOCI): sensitive, broadly applicable homogeneous immunoassay method. Clin. Chem. 1996, 42 (9), 1518-1526.
3. Yoshioka, Y.; Kosaka, N.; Konishi, Y.; Ohta, H.; Okamoto, H.; Sonoda, H.; Nonaka, R.; Yamamoto, H.; Ishii, H.; Mori, M.; Furuta, K.; Nakajima, T.; Hayashi, H.; Sugisaki, H.; Higashimoto, H.; Kato, T.; Takeshita, F.; Ochiya, T., Ultra-sensitive liquid biopsy of circulating extracellular vesicles using ExoScreen. Nat. Commun. 2014, 5, 3591.
4. Stephens, A.; Nidetz, R.; Mesyngier, N.; Chung, M. T.; Song, Y.; Fu, J.; Kurabayashi, K., Mass-producible microporous silicon membranes for specific leukocyte subset isolation, immunophenotyping, and personalized immunomodulatory drug screening in vitro. Lab Chip 2019, 19 (18), 3065-3076.
5. Yu, Z. T.; Guan, H.; Cheung, M. K.; McHugh, W. M.; Cornell, T. T.; Shanley, T. P.; Kurabayashi, K.; Fu, J., Rapid, automated, parallel quantitative immunoassays using highly integrated microfluidics and AlphaLISA. Sci. Rep. 2015, 5, 11339.
本文作者
沈斌 博士
上海羧菲生物医药科技有限公司